研究
細胞外小胞エクソソームの機能解明と医療への応用
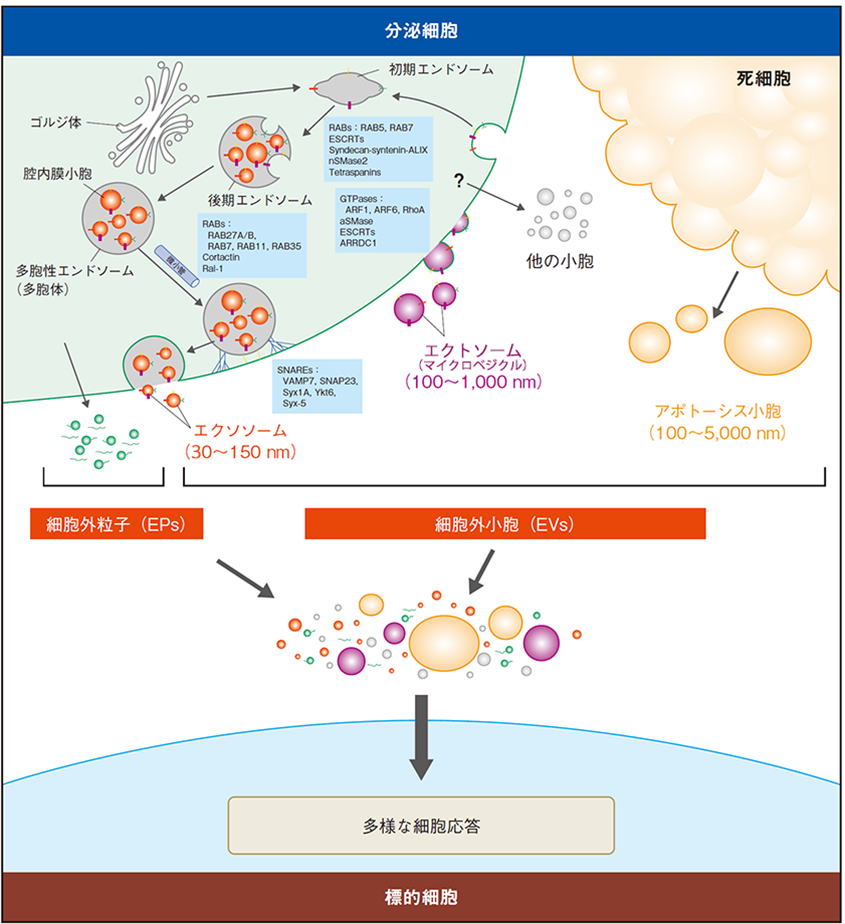
様々な細胞がエクソソームなどの細胞外小胞を放出することで、多様な細胞応答を引き起こします(下図)。エクソソームは脂質二重膜で囲まれた小胞(直径30-150nm程)で、分泌細胞由来の膜蛋白質と細胞質成分で構成されています。これらの構成成分は細胞・疾患ごとに異なる為、血液や尿などの体液から採取したエクソソームの解析による病気の早期発見や予後診断が期待されています。
長年エクソソームは、不要な細胞内成分を細胞外へと放出する為の機構と考えられてきました。中でも、アルツハイマー病やパーキンソン病などの原因蛋白質が、エクソソームにより細胞外へと放出される機構は、これらの疾患発症に関与すると考えられています。一方、エクソソームには、その標的細胞に分泌細胞由来の分子を運搬する機能があることが見いだされています。例えば、免疫細胞由来エクソソームには抗原/MHC複合体が含まれており、免疫細胞間での抗原情報の伝達や、免疫細胞の活性化・不活性化など様々な免疫応答を制御することが示されています。更に近年、エクソソームには、分泌細胞由来のmRNAやmicroRNAが存在することが明らかとなり、細胞間の遺伝子発現情報の交換に関与することが示されています。このようにエクソソームには細胞間の情報伝達メッセンジャーとして、多くの重要な機能がありますが、その研究はまだ始まったばかりであり、今後大きな発展が期待される研究分野です。
私達は最先端の解析技術を用いて、新たな情報伝達ネットワークを担うエクソソームの生理・病態生理機能に取り組んでいます。特に、エクソソームを介した免疫制御や神経変性、癌進展などの分子機構を解明し、これらの疾患の病態解明に貢献することを目標にしています。また、エクソソームの高純度精製法や高感度定量法、機能改変法などの技術確立により、エクソソームを用いた革新的予防・診断・治療法の開発を目指しています。
【研究成果の解説は論文にあります】
実験医学増刊 Vol.39 No.20 「EVs 細胞外小胞の生物学」より